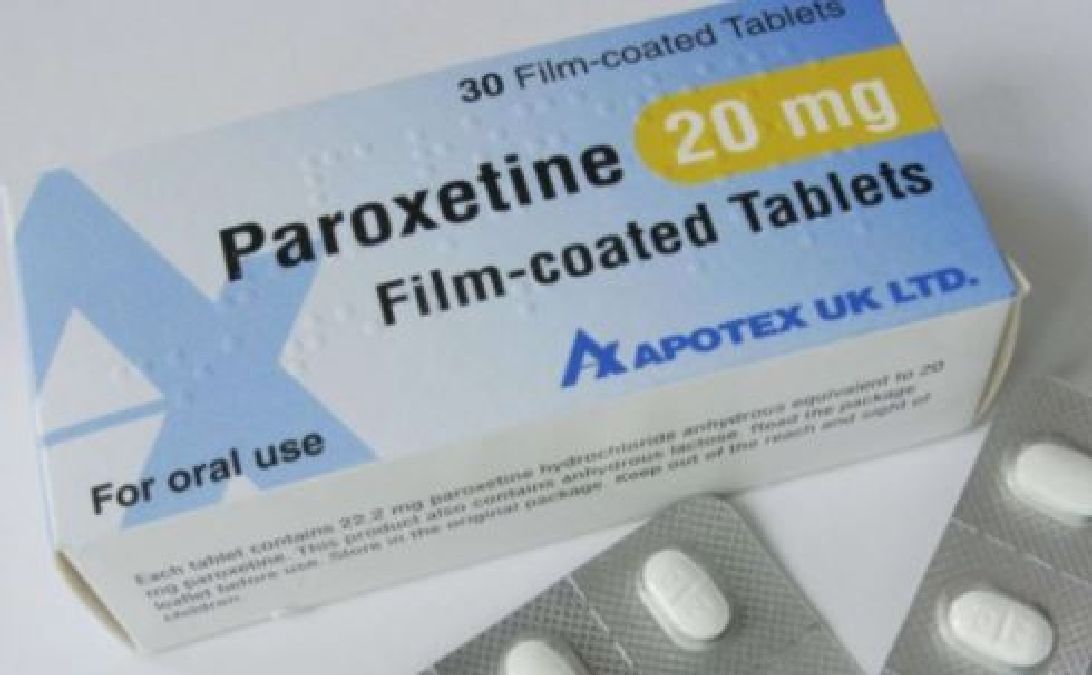
 Ce médicament est commercialisé en France sous le nom de Deroxat® depuis le 19 février 1995. Cependant, un article du « British Medical Journal » remet aujourd'hui sérieusement en cause l’efficacité de ce médicament.
Ce médicament est commercialisé en France sous le nom de Deroxat® depuis le 19 février 1995. Cependant, un article du « British Medical Journal » remet aujourd'hui sérieusement en cause l’efficacité de ce médicament.
L’article du « British Medical Journal » résulte d’un travail original mené par un groupe international dirigé par Joanna Le Noury (université de Bangor, pays de Galles).
L’histoire débute en 2001, avec une publication dans la revue spécialisée « Journal of The American Academy of Child and Adolescent Psychiatry », où un essai comparant la paroxétine et l'imipramine (un antidépresseur d’une autre famille) a été publié. Cet essai a été fait sur 275 adolescents souffrant d’une dépression sévère, et suivis pendant huit semaines et a conclu que La paroxétine est généralement bien tolérée et efficace dans la dépression sévère de l'adolescent.
Mais les résultats de cet essai sont très contestés pendant de nombreuses années et, après de nombreuses difficultés pour avoir accès aux données, une nouvelle analyse arrive à une conclusion radicalement différente de la première : Ni la paroxétine, ni l'imipramine n'ont montré une quelconque efficacité pour traiter la dépression sévère chez les adolescents. Les deux médicaments avaient au contraire montré une augmentation des risques de dépression.
Plusieurs autres recherches ont ensuite prouvé que la paroxétine n’était pas plus efficace qu’un placébo pour traiter la dépression chez les mineurs et que le rapport risque-bénéfice n’était pas en faveur de cette molécule.
La revue médicale britannique est cinglante vis-à-vis de GlaxoSmithKline ainsi que vis-à-vis de l’ensemble du système: «Pas de correction, pas de rétractation, pas d'excuses, pas de commentaires. Cette ré-analyse pose des questions sur les responsabilités institutionnelles.»
Cette affaire exemplaire dépasse le seul cas de la paroxétine. L’accès aux données des essais cliniques doit devenir obligatoire et il est indispensable que des chercheurs indépendants soient en charge de ces études et non le laboratoire clinique (juge et partie).
En France, de nouvelles mises en garde ont été ajoutées dans les notices des médicaments à base de paroxétine depuis 2007. Ces dernières concernent l’augmentation du risque de malformations congénitales et d’hypertension artérielle chez les enfants dont la mère a été traitée par la paroxétine pendant le premier trimestre de grossesse.
Mais une mise en garde spéciale qui alerte sur l’augmentation du risque suicidaire chez les adolescents traités par paroxétine a également été ajoutée.